지난 20여 년간 암의 진단과 치료에 있어 괄목할 만한 기술적 진보가 있었지만 암으로 인한 치사율은 아직까지도 높은 현실이다. 항암치료 저항성을 가진 암세포의 지속적 출현으로 암이 재발될 수 있다는 것이 현재 기술의 한계다.
장기가 손상을 받을 때 인체의 각 장기에 존재하는 성체 줄기세포가 재생하고 유지하는 역할을 하듯이, 암 조직에도 일반 장기처럼 암 조직을 유지하는 구실을 하는 암줄기세포가 존재한다. 이것이 암 치료 후 줄어든 암세포를 재생하는 데 관여함으로써 암의 재발이나 전이에 깊은 영향을 미친다고 보고되고 있다.
따라서 암 조직의 대부분을 차지하는 일반 암세포만 표적으로 개발된 기존의 암 치료보다는 암 조직의 극히 일부만 차지하면서도 암의 발병과 유지 및 재발에 핵심 역할을 하는 암줄기세포에 초점을 맞춘 연구가 진행될 필요성이 대두되고 있다. 현재까지 유방암, 골육종, 피부암, 뇌종양, 췌장암, 전립선암과 같은 고형암과 백혈병과 같은 혈액암에서 암줄기세포를 분리하고 살피는 연구가 활발히 진행되고 있다.
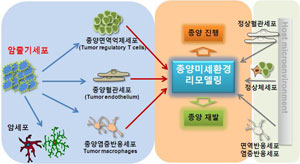
그동안 고려대 생명공학부 김형기 교수 연구팀은 '암줄기세포 생성유전자, ID4의 작용 기전 규명'과 '종양혈관에 의한 암줄기세포 생성 리프로그래밍 기전 연구'를 진행해왔다. 이 같은 연구는 암생물학 분야의 새로운 패러다임인 암줄기세포의 발생 조절 신호 기전과 종양 미세환경의 형성, 상호기전을 이해함으로써 암줄기세포와 종양 미세환경 표적 맞춤형 치료법을 개발하기 위해서다.
최근 관련 연구가 이뤄지면서 종양 조직 내 복잡한 군집을 형성하고 있는 세포들 가운데 일부 줄기세포의 특성을 가진 미분화 암세포만이 종양을 형성할 수 있다는 사실이 알려지게 됐다. 암줄기세포라는 이름으로 불리는 이들 세포들은 주어진 환경에 종양조직의 대부분을 차지하는 세포들로 분화돼 종양조직 자체를 형성할 뿐 아니라 항암제나 방사선 치료에 저항성을 가지고 있어 종양 재발의 원인이 된다.
성체줄기세포와 같이 지속적으로 분열 가능한 세포에 존재하는 암 유발 유전자나 암 억제 유전자에 돌연변이가 발생하면 암줄기세포로 발전할 수 있다. 분화된 일반 암세포에서도 줄기세포의 특성을 조절하는 유전자가 활성화되면 암줄기세포로 역분화 또는 리프로그래밍이 되기도 한다.
암줄기세포는 종양의 발달 과정에서 주변 미세환경에 존재하는 혈관 내피세포를 자극해 신생 혈관의 형성을 촉진하고 이렇게 형성된 종양조직 내 혈관 내피세포는 영양분과 산소의 공급 및 폐기물 운반작용을 하게 된다. 특히 종양조직 내 암줄기세포와 주변 미세환경, 혈관내피세포 및 면역세포와의 신호전달체계, 그리고 이에 따른 종양 생성과 이 과정이 진행돼 악성화될 수 있는 내용을 소개할 것이다.
기존의 암 치료방법은 암세포를 표적으로 한 항암치료. 이 치료가 악성 암줄기세포 군집의 성장을 유도해 종양 재발을 촉진할 수도 있다는 가능성이 제시되고 있다. 따라서 이번 강연에서는 암줄기세포를 특이적으로 사멸시키는 것이 종양 재발과 타 조직으로의 전이를 억제할 수 있을 것이라는 점과 함께 암줄기세포와 이들의 발생 및 특성 조절에 중요한 종양 미세환경을 통제할 수 있도록 암줄기세포 표적 항암치료제가 개발돼야 한다는 점을 강조할 것이다.







